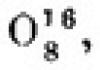Ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после ).
Смотрите так же:
СТРУКТУРА

Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а 0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a 0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С -а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С - аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) - д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа - это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая - 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа - хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо - один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

В земной коре железо распространено достаточно широко - на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало - в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe 2 O 4 , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe 3 (PO 4) 2 ·8H 2 O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10 −5 -1·10 −8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe 2 O 3) и магнетита (FeO·Fe 2 O 3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства - восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe 1-x S) и когенит (Fe 3 C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO) n . В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Железо - один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов - важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов - например, никелевых.
Магнитная окись железа (магнетит) - важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
История
Железо, как инструментальный материал, известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), украшения из египетских гробниц (около 3800 года до н. э.) и кинжал из шумерского города Ура (около 3100 года до н. э.). От небесного происхождения метеоритного железа происходит, видимо, одно из названий железа в греческом и латинском языках: «сидер» (что значит «звёздный»).
Изделия из железа, полученного выплавкой, известны со времени расселения арийских племён из Европы в Азию, острова Средиземного моря, и далее (конец 4-го и 3-е тысячелетие до н. э. ). Самые древние железные инструменты из известных - стальные лезвия, найденные в каменной кладке пирамиды Хеопса в Египте (построена около 2530 года до н. э. ). Как показали раскопки в Нубийской пустыне, уже в те времена египтяне, стараясь отделить добываемое золото от тяжёлого магнетитового песка, прокаливали руду с отрубями и подобными веществами, содержащими углерод. В результате на поверхности расплава золота всплывал слой тестообразного железа, который обрабатывали отдельно. Из этого железа ковались орудия, в том числе найденные в пирамиде Хеопса. Однако после внука Хеопса Менкаура (2471-2465 год до н. э.) в Египте наступила смута: знать во главе со жрецами бога Ра свергла правящую династию, и началась чехарда узурпаторов, закончившаяся воцарением фараона следующей династии Усеркара, которого жрецы объявили сыном и воплощением самого бога Ра (с тех пор это стало официальным статусом фараонов). В ходе этой смуты культурные и технические знания египтян пришли в упадок, и, так же как деградировало искусство строительства пирамид, технология производства железа была утеряна , вплоть до того, что позднее, осваивая в поисках медной руды Синайский полуостров, египтяне не обратили никакого внимания на имевшиеся там залежи железной руды, а получали железо от соседних хеттов и митаннийцев.
Первые освоили производства железа хатты , на это указывает древнейшее (2-е тысячелетие до н. э.) упоминание железа в текстах хеттов , основавших свою империю на территории хатттов (современной Анатолии в Турции). Так, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошел, человек из города Пурусханды ко мне поклониться пришел (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнес…
(источник: Гиоргадзе Г. Г. // Вестник древней истории. 1965. № 4.)
В древности мастерами железных изделий слыли халибы . В легенде об аргонавтах (их поход в Колхиду состоялся примерно за 50 лет до троянской войны) рассказывается, что царь Колхиды Эет дал Ясону железный плуг чтобы он вспахал поле Ареса, и описываются его подданные халиберы:
Они не пашут землю, не сажают плодовые деревья, не пасут стада на тучных лугах; они добывают руду и железо из необработанной земли и выменивают на них продукты питания. День не начинается для них без тяжкого труда, в темноте ночи и густом дыму проводят они, работая весь день…
Аристотель описал их способ получения стали: «халибы несколько раз промывали речной песок их страны - тем самым выделяя чёрный шлих (тяжелая фракция состоящая в основном из магнетита и гематита), и плавили в печах; полученный таким образом металл имел серебристый цвет и был нержавеющим».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря : эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита , и обломков других пород, так что выплавляемая халибами сталь была легированной, и имела превосходные свойства. Такой своеобразный способ получения железа говорит о том, что халибы лишь распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона , у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди , серебра , золота и железа у древних хеттов были в соотношении 1: 160: 1280: 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога.
В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе - возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона Тутанхамона и его тестя Хаттусиля - царя хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя, и посылает только один кинжал из «хорошего железа» (то есть стали). Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты новые месторождения железа и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады » Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев :
«Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полоненых. И пир уготовлен веселый…»
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
«Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…»
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах - от древнего «Horn» - рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру - заметно меньше температуры плавления чугуна , поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. Так получалось «хорошее железо» - и хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими и твердыми, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке - домна , домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 градусов, а чистое железо плавится при 1535 градусах). При этом образуется чугун с температурой плавления 1100-1200 градусов, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке) и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron , по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторной переплавке в печи с усиленным продуванием через него воздуха, чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Библиография: Карл Бакс. Богатства земных недр. М.: Прогресс, 1986, стр. 244, глава «Железо»
Происхождение названия
Имеется несколько версий происхождения славянского слова «железо» (белор. жалеза , укр. залізо , ст.-слав. желѣзо , болг. желязо , сербохорв. жељезо , польск. żelazo , чеш. železo , словен. železo ).
Одна из этимологий связывает праслав. *želězo с греческим словом χαλκός , что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха » и *glazъ «скала», с общей семой «камень » . Третья версия предполагает древнее заимствование из неизвестного языка .
Германские языки заимствовали название железа (готск. eisarn , англ. iron , нем. Eisen , нидерл. ijzer , дат. jern , швед. järn ) из кельтских .
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h 1 esh 2 r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish 2 ro- «сильный, святой, обладающий сверхъестественной силой» .
Древнегреческое слово σίδηρος , возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра .
Название природного карбоната железа (сидерита) происходит от лат. sidereus - звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus , означающее «звезда», вероятно, имеют общее происхождение.
Изотопы
Природное железо состоит из четырёх стабильных изотопов : 54 Fe (изотопная распространённость 5,845 %), 56 Fe (91,754 %), 57 Fe (2,119 %) и 58 Fe (0,282 %). Так же известно более 20 нестабильных изотопов железа с массовыми числами от 45 до 72, наиболее устойчивые из которых - 60 Fe (период полураспада по уточнённым в 2009 году данным составляет 2,6 миллиона лет ), 55 Fe (2,737 года), 59 Fe (44,495 суток) и 52 Fe (8,275 часа); остальные изотопы имеют период полураспада менее 10 минут .
Изотоп железа 56 Fe относится к наиболее стабильным ядрам: все следующие элементы могут уменьшить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы уменьшить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд (см. Железная звезда), а все последующие элементы могут образоваться только в результате взрывов сверхновых .
Геохимия железа
Гидротермальный источник с железистой водой. Оксиды железа окрашивают воду в бурый цвет
Железо - один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию . При этом в ядре находится около 86 % всего железа, а в мантии 14 %. Содержание железа значительно повышается в изверженных породах основного состава, где оно связано с пироксеном, амфиболом, оливином и биотитом. В промышленных концентрациях железо накапливается в течение почти всех экзогенных и эндогенных процессов, происходящих в земной коре. В морской воде железо содержится в очень малых количествах 0,002-0,02 мг/л. В речной воде несколько выше - 2 мг/л.
Геохимические свойства железа
Важнейшая геохимическая особенность железа - наличие у него нескольких степеней окисления. Железо в нейтральной форме - металлическое - слагает ядро земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO - основная форма нахождения железа в мантии и земной коре. Окисное железо Fe 2 O 3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород .
По кристаллохимическим свойствам ион Fe 2+ близок к ионам Mg 2+ и Ca 2+ - другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит , Fe 2 O 3 ; содержит до 70 % Fe), магнитный железняк (магнетит , FeFe 2 O 4 , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O). Гётит и гидрогётит чаще всего встречаются в корах выветривания , образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые , или бобовые, железные руды. В них часто встречается вивианит Fe 3 (PO 4) 2 ·8H 2 O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты .
В природе также широко распространены сульфиды железа - пирит FeS 2 (серный или железный колчедан) и пирротин . Они не являются железной рудой - пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде - 1·10 −5 -1·10 −8 %.
Другие часто встречающиеся минералы железа:
- Сидерит - FeCO 3 - содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. Плотность равна 3 г/см³ и твёрдость 3,5-4,5 по шкале Мооса.
- Марказит - FeS 2 - содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6-4,9 г/см³ и твёрдостью 5-6 по шкале Мооса.
- Лёллингит - FeAs 2 - содержит 27,2 % железа и встречается в виде серебристо-белых бипирамидальных ромбических кристаллов. Плотность равна 7-7,4 г/см³, твёрдость 5-5,5 по шкале Мооса.
- Миспикель - FeAsS - содержит 34,3 % железа. Встречается в виде белых моноклинных призм с плотностью 5,6-6,2 г/см³ и твёрдостью 5,5-6 по шкале Мооса.
- Мелантерит - FeSO 4 ·7H 2 O - реже встречается в природе и представляет собой зелёные (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском, хрупкие. Плотность равна 1,8-1,9 г/см³.
- Вивианит - Fe 3 (PO 4) 2 ·8H 2 O - встречается в виде сине-серых или зелено-серых моноклинных кристаллов с плотностью 2,95 г/см³ и твёрдостью 1,5-2 по шкале Мооса.
Помимо вышеописанных минералов железа существуют, например:
Основные месторождения
По данным Геологической службы США (оценка 2011 г.), мировые разведанные запасы железной руды составляют порядка 178 млрд тонн. Основные месторождения железа находятся в Бразилии (1 место), Австралии, США, Канаде, Швеции, Венесуэле, Либерии, Украине, Франции, Индии. В России железо добывается на Курской магнитной аномалии (КМА), Кольском полуострове, в Карелии и в Сибири. Значительную роль в последнее время приобретают донные океанские месторождения, в которых железо совместно с марганцем и другими ценными металлами находится в конкрециях.
Получение
В промышленности железо получают из железной руды , в основном из гематита (Fe 2 O 3) и магнетита (FeO·Fe 2 O 3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства - восстановление железа углеродом в доменной печи при температуре 2000 °C . В доменной печи углерод в виде кокса , железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода . Данный оксид образуется при горении в недостатке кислорода :
В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III) :
Оксид кальция соединяется с диоксидом кремния, образуя шлак - метасиликат кальция:
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности - это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи , содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера , фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана , которые содержат водород . Водород легко восстанавливает железо:
,при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле . Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей .
Физические свойства
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α-γ переходам кристаллической решётки происходит термообработка стали . Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлом . В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления железа 1539 °C, температура кипения - 2862 °C.
Химические свойства
Характерные степени окисления
- Кислота в свободном виде не существует - получены только её соли.
Для железа характерны степени окисления железа - +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH) 2 . Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) - слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe 2 O 3 и коричневый гидроксид Fe(OH) 3 . Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe 3+ нацело гидролизуются даже в кислой среде. Fe(OH) 3 растворяется (и то не полностью), только в концентрированных щелочах. Fe 2 O 3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли кислоты несуществующей в свободном виде кислоты HFeO 2):
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe 3 O 4 , формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe +2 (Fe +3 O 2) 2 .
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли - ферраты (например, K 2 FeO 4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Свойства простого вещества
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида , препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины , который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe 2 O 3 ·xH 2 O.
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH) 2 . Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
Из солей железа(II) в водных растворах устойчива соль Мора - двойной сульфат аммония и железа(II) (NH 4) 2 Fe(SO 4) 2 ·6Н 2 O.
Реактивом на ионы Fe 2+ в растворе может служить гексацианоферрат(III) калия K 3 (красная кровяная соль). При взаимодействии ионов Fe 2+ и 3− выпадает осадок турнбулевой сини :
Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen 3 (максимум светопоглощения - 520 нм) в широком диапазоне рН (4-9) .
Соединения железа (III)
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов , например, KFe(SO 4) 2 - железокалиевые квасцы, (NH 4)Fe(SO 4) 2 - железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe 3+ с тиоцианат-ионами SCN − . При взаимодействии ионов Fe 3+ с анионами SCN − образуется смесь ярко-красных роданидных комплексов железа 2+ , + , Fe(SCN) 3 , - . Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe 3+ служит гексацианоферрат(II) калия K 4 (жёлтая кровяная соль). При взаимодействии ионов Fe 3+ и 4− выпадает ярко-синий осадок берлинской лазури :
Соединения железа (VI)
Окислительные свойства ферратов используют для обеззараживания воды.
Соединения железа VII и VIII
Имеются сообщения об электрохимическом получении соединений железа(VIII). , , , однако независимых работ, подтверждающих эти результаты, нет.
Применение

Железная руда
Железо - один из самых используемых металлов , на него приходится до 95 % мирового металлургического производства.
- Железо является основным компонентом сталей и чугунов - важнейших конструкционных материалов.
- Железо может входить в состав сплавов на основе других металлов - например, никелевых.
- Магнитная окись железа (магнетит) - важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
- Ультрадисперсный порошок магнетита используется во многих черно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
- Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
- Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат .
- Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
- Железо применяется в качестве анода в железо-никелевых аккумуляторах , железо-воздушных аккумуляторах .
- Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 % являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемом . В частности, этот комплекс присутствует в гемоглобине - важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол , в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК .
Неорганические соединения железа встречаются в некоторых бактериях , иногда используется ими для связывания азота воздуха.
В организм животных и человека железо поступает с пищей (наиболее богаты им печень , мясо , яйца , бобовые , хлеб , крупы , свёкла). Интересно, что некогда шпинат ошибочно был внесён в этот список (из-за опечатки в результатах анализа - был потерян «лишний» ноль после запятой).
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Примечания
- Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). - М .: Советская энциклопедия, 1990. - Т. 2. - С. 140. - 671 с. - 100 000 экз.
- Карапетьянц М. Х. , Дракин С. И. Общая и неорганическая химия: Учебник для вузов. - 4-е изд., стер. - М.: Химия, 2000, ISBN 5-7245-1130-4 , с. 529
- М. Фасмер. Этимологический словарь русского языка. - Прогресс. - 1986. - Т. 2. - С. 42-43.
- Трубачёв О. Н. Славянские этимологии. // Вопросы славянского языкознания, № 2, 1957.
- Boryś W. Słownik etymologiczny języka polskiego. - Kraków: Wydawnictwo Literackie. - 2005. - С. 753-754.
- Walde A. Lateinisches etymologisches Wörterbuch. - Carl Winter’s Universitätsbuchhandlung. - 1906. - С. 285.
- Мейе А. Основные особенности германской группы языков. - УРСС. - 2010. - С. 141.
- Matasović R. Etymological Dictionary of Proto-Celtic. - Brill. - 2009. - С. 172.
- Mallory, J. P., Adams, D. Q. Encyclopedia of Indo-European Culture. - Fitzroy-Dearborn. - 1997. - P. 314.
- «New Measurement of the 60 Fe Half-Life». Physical Review Letters 103 : 72502. DOI :10.1103/PhysRevLett.103.072502 .
- G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties ». Nuclear Physics A 729 : 3–128. DOI :10.1016/j.nuclphysa.2003.11.001 .
- Ю. М. Широков, Н. П. Юдин. Ядерная физика. М.: Наука, 1972. Глава Ядерная космофизика .
- Р. Рипан, И. Четяну. Неорганическая химия // Химия неметаллов = Chimia metalelor. - Москва: Мир, 1972. - Т. 2. - С. 482-483. - 871 с.
- Gold and Precious Metals
- Металловедение и термическая обработка стали. Справ. изд. В 3-х т./ Под ред. М. Л. Берштейна, А. Г. Рахштадта. - 4-е изд., перераб. и доп. Т. 2. Основы термической обработки. В 2-х кн. Кн. 1. М.: Металлургия, 1995. 336 с.
- T. Takahashi & W.A. Bassett, "High-Pressure Polymorph of Iron ," Science , Vol. 145 #3631, 31 Jul 1964, p 483-486.
- Schilt A. Analytical Application of 1,10-phenantroline and Related Compounds. Oxford, Pergamon Press, 1969.
- Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989. С. 297.
- Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989, С. 315.
- Брауэр Г. (ред.) Руководство по неорганическому синтезу. т. 5. М., Мир, 1985. С. 1757-1757.
- Реми Г. Курс неорганической химии. т. 2. М., Мир, 1966. С. 309.
- Киселёв Ю. М., Копелев Н. С., Спицын В. И., Мартыненко Л. И. Восьмивалентное железо // Докл. АН СССР. 1987. Т.292. С.628-631
- Перфильев Ю. Д., Копелев Н. С., Киселёв Ю. М., Спицын В. И. Мёссбауэровское исследование восьмивалентного железа // Докл. АН СССР. 1987. T.296. С.1406-1409
- Kopelev N.S., Kiselev Yu.M., Perfiliev Yu.D. Mossbauer spectroscopy of the oxocomplexes iron in higher oxidation states // J. Radioanal. Nucl. Chem. 1992. V.157. Р.401-411.
- «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» МР 2.3.1.2432-08
Источники (к разделу История)
- Г. Г. Гиоргадзе. «Текст Анитты» и некоторые вопросы ранней истории хеттов
- Р. М. Абрамишвили. К вопросу об освоении железа на территории Восточной Грузии, ВГМГ, XXII-В, 1961.
- Хахутайшвили Д. А. К истории древнеколхской металлургии железа. Вопросы древней истории (Кавказско-ближневосточный сборник, вып. 4). Тбилиси, 1973.
- Геродот. «История», 1:28.
- Гомер. «Илиада», «Одиссея».
- Вергилий. «Энеида», 3:105.
- Аристотель. «О невероятных слухах», II, 48. ВДИ, 1947, № 2, стр. 327.
- Ломоносов М. В. Первые основания металлургии.
См. также
- Категория:Соединения железа
Ссылки
- Болезни, вызванные недостатком и избытком железа в организме человека
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
ЖЕЛЕЗО, Fe (а. iron; н. Eisen; ф. fer; и. hierro), — химический элемент VIII группы периодической системы элементов , атомный номер 26, атомная масса 55,847. Природное состоит из 4 стабильных изотопов: 54 Fe (5,84%), 56 Fe (91,68%), 57 Fe (2,17%) и 58 Fe (0,31%). Получены радиоактивные изотопы 52 Fe, 53 Fe, 55 Fe, 59 Fe, 60 Fe. Железо известно с доисторических времён. Впервые человек, вероятно, познакомился с метеоритным железом, т.к. древнеегипетское название железа "бени-пет" означает небесное железо. В хеттских текстах встречается упоминание о железе как о металле, упавшем с неба.
Железо в природе
Железо — единственный породообразующий элемент с переменной валентностью. Отношение оксидного железа к закисному устойчиво растёт с увеличением кремнекислотности расплавов. Ещё больший рост происходит в щелочных системах, где минерал, содержащий трёхвалентное железо — , (Na,Fe)Si 2 О 6 , становится породообразующим. В метаморфическом процессе железо, по-видимому, мало подвижно. Содержание железа в современных океанических осадках близко к содержаниям в древних глинистых породах и глинистых . Основные генетические типы месторождений и схемы обогащения смотреть в статье .
Получение железа
Чистое железо получают восстановлением из оксидов (железо пирофорное), электролизом водных растворов его солей (железо электролитическое), разложением пентакарбонила железа Fe(CO) 5 при нагревании до t 250°С. Особо чистое железо (99,99%) получают с помощью зонной плавки. Технически чистое железо (около 0,16% примесей углерода, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных и в кислородных конверторах. Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным или путём восстановления руд твёрдым углеродом. Основную массу железа выплавляют в виде сталей (до 2% углерода) или чугунов (свыше 2% углерода).
Применение железа
Железоуглеродистые сплавы — основа конструкции материалов, применяющихся во всех отраслях промышленности. Техническое железо — материал для сердечников электромагнитов и якорей электромашин, пластин аккумуляторов. Железный порошок в больших количествах применяется при сварке. Оксиды железа — минеральные краски; ферромагнитные Fe 3 О 4 , g-Fe используются для производства магнитных материалов. Сульфат FeSO 4 .7Н 2 О применяется в текстильной промышленности, в производстве берлинской лазури, чернил; FeSO4 — коагулянт для . Железо используется также в полиграфии, медицине (как антианемическое средство); искусственные радиоактивные изотопы железа — индикаторы при исследовании химико-технологических и биологических процессов.
(т.н. метеоритное железо, которое содержит более 90% Fe). В соединениях с кислородом и другими элементами широко распространено в составе многих минералов и руд. По распространенности в земной коре (5,00%) это третий (после кремния и алюминия) элемент; считается, что земное ядро состоит в основном из железа. Основные минералы - гематит (красный железняк) Fe 2 O 3 ; лимонит Fe 2 O 3 ·nH 2 O (n = 1 - 4), содержащийся, например, в болотной руде; магнетит (магнитный железняк) Fe 3 O 4 и сидерит FeCO 3 . Наиболее распространенным минералом железа, не являющимся, однако, источником его получения, является пирит (серный колчедан, железный колчедан) FeS 2 , который иногда называют за его желтый блеск золотом дураков или кошачьим золотом , хотя он в действительности часто содержит небольшие примеси меди , золота , кобальта и других металлов.
| СВОЙСТВА ЖЕЛЕЗА | |
|---|---|
| Атомный номер | 26 |
| Атомная масса | 55,847 |
| Изотопы : | |
| стабильные | 54, 56, 57, 58 |
| нестабильные | 52, 53, 55, 59 |
| Температура плавления , °С | 1535 |
| Температура кипения , °С | 3000 |
| Плотность , г/см3 | 7,87 |
| Твердость (по Моосу) | 4,0-5,0 |
| Содержание в земной коре, % (масс.) | 5,00 |
| Степень окисления: | |
| характерная | +2, +3 |
| прочие значения | +1, +4, +6 |
История
Железо (элементное) известно и используется с доисторических времен. Первые изделия из железа, вероятно, были изготовлены из метеоритного железа в виде амулетов, драгоценностей и рабочего инструмента. Около 3500 лет назад человек открыл способ восстановления красной земли, содержащей оксид железа, в металл . С тех пор из железа было изготовлено огромное количество различных изделий. Оно сыграло важную роль в развитии материальной культуры человечества. В наши дни железо в основном (95%) выплавляют из руд в виде чугунов и сталей и в сравнительно небольших количествах получают восстановлением металлизованных окатышей, а чистое железо - термическим разложением его соединений или электролизом солей .
Свойства
Металлическое железо представляет собой серовато-белое блестящее твердое пластичное вещество. Железо кристаллизуется в трех модификациях (α, γ, δ). α-Fe имеет объемноцентрированную кубическую кристаллическую решетку , химически устойчиво до 910°С. При 910°С α-Fe переходит в γ-Fe, стабильное в интервале 910-1400°С; γ-Fe кристаллизуется в гранецентрированной кубической кристаллической решетке . При температуре выше 1400°С образуется δ-Fe с решеткой, в основном аналогичной решетке α-Fe. Железо - ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при снятии магнитного поля . С повышением температуры магнитные свойства железа ухудшаются и выше 769°С оно практически не поддается намагничиванию (иногда железо в интервале 769-910°С называют &betta;-Fe); γ-Fe не является магнитным материалом.
Использование
Железо - один из самых пригодных к эксплуатации металлов в сплаве с углеродом (сталь , чугун) - высокопрочная основа конструкционных материалов. Как материал, обладающий магнитными свойствами, железо используется для сердечников электромагнитов и якорей электромашин, а также в качестве слоев и пленок на магнитных лентах. Чистое железо - катализатор в химических процессах, компонент лекарственных средств в медицине.
Железо как химический компонент организма
Железо является существенным химическим компонентом организмов многих позвоночных, беспозвоночных и некоторых растений. Оно входит в состав гема (пигмента эритроцитов - красных кровяных клеток) гемоглобина крови, мышечных тканей, костного мозга, печени и селезенки. Каждая молекула гемоглобина содержит 4 атома железа, которые способны создавать обратимую и непрочную связь с кислородом , образуя оксигемоглобин. Кровь, содержащая оксигемоглобин, циркулирует по телу, поставляя кислород к тканям для клеточного дыхания. Поэтому железо необходимо для дыхания и образования красных кровяных клеток. Миоглобин (или мышечный гемоглобин) снабжает кислородом мышцы. Общее количество железа в человеческом теле (средней массы 70 кг) составляет 3-5 г. Из этого количества 65% Fe находится в гемоглобине. От 10 до 20 мг Fe ежедневно требуется для обеспечения нормального метаболизма среднего взрослого. Красное мясо, яйца, желток, морковь, фрукты, любая пшеница и зеленые овощи в основном обеспечивают организм железом при нормальном питании; при анемии, связанной с недостатком железа в организме, принимают лекарственные препараты железа.
Железо как хим. элемент
С химической точки зрения железо - довольно активный металл , проявляет характерные степени окисления +2, +3, реже +1, +4, +6. Непосредственно соединяется с некоторыми элементами, с S образует FeS - сульфид железа(III), с галогенами , кроме иода , - галогениды железа(III), такие, как FeCl 3 . Легко окисляется; с кислородом дает оксиды FeO, Fe 2 O 3 , Fe 3 O 4 (FeO + Fe 2 O 3), легко корродирует (ржавеет). Вытесняет водород из паров воды при высокой температуре . Растворяется в разбавленных кислотах (например, HCl, H 2 SO 4 , HNO 3), вытесняя водород и образуя соли Fe(II) (соответственно FeCl 2 , FeSO 4 , Fe(NO 3) 2). В умеренно концентрированных H 2 SO 4 и HNO 3 железо растворяется с образованием солей Fe(III), а в сильноконцентрированных - пассивируется и не реагирует. Пассивность железа, по-видимому, объясняется образованием на его поверхности пленки оксида железа, которая, однако, легко разрушается при простом соскабливании.
Коррозия железа
Ржавление железа (атмосферная коррозия железа) - это окисление его кислородом воздуха . Реакция происходит в присутствии ионов солей , растворенных в воде , и ионов , образующихся при диссоциации угольной кислоты - продукта взаимодействия атмосферного углекислого газа и влаги . В результате образуется рыхлая ржавчина красного цвета, или гидратированный оксид состава Fe 2 O 3 ·nH 2 O.
Соединения
Комплексные соединения
| Химические элементы и материалы |
||
|---|---|---|
| Химические элементы | ||
Железо - восьмой элемент четвёртого периода в таблице Менделеева. Его номер в таблице (также его называют атомным) 26, что соответствует числу протонов в ядре и электронов в электронной оболочке. Обозначается первыми двумя буквами своего латинского эквивалента - Fe (лат. Ferrum - читается как «феррум»). Железо - второй по распространённости элемент в земной коре, процентное содержание - 4,65% (самый распространённый - алюминий, Al). В самородном виде данный металл встречается достаточно редко, чаще его добывают из смешанной руды с никелем.
Вконтакте
 Какова же природа данного соединения? Железо как атом состоит из металлической кристаллической решётки, за счёт чего обеспечивается твёрдость соединений, содержащих этот элемент, и молекулярная стойкость. Именно в связи с этим данный металл - типичное твёрдое тело в отличие, например, от ртути.
Какова же природа данного соединения? Железо как атом состоит из металлической кристаллической решётки, за счёт чего обеспечивается твёрдость соединений, содержащих этот элемент, и молекулярная стойкость. Именно в связи с этим данный металл - типичное твёрдое тело в отличие, например, от ртути.
Железо как простое вещество - металл серебристого цвета c типичными для этой группы элементов свойствами: ковкость, металлический блеск и пластичность. Помимо этого, железо обладает высокой реакционной активностью. О последнем свойстве свидетельствует тот факт, что железо очень быстро подвергается коррозии при наличии высокой температуры и соответствующей влажности. В чистом кислороде этот металл хорошо горит, а если раскрошить его на очень мелкие частицы, то они будут не просто гореть, а самовозгораться.
Зачастую железом мы называем не чистый металл, а его сплавы, содержащих углерод ©, например, сталь (<2,14% C) и чугун (>2,14% C). Также важное промышленное значение имеют сплавы, в которые добавляются легирующие металлы (никель, марганец, хром и другие), за счёт них сталь становится нержавеющей, т. е. легированной. Таким образом, исходя из этого становится понятным, какое обширное промышленное применение имеет этот металл.
Характеристика Fe

Химические свойства железа
Рассмотрим подробнее особенности этого элемента.
Свойства простого вещества
- Окисление на воздухе при высокой влажности (коррозийный процесс):
4Fe+3O2+6H2O = 4Fe (OH)3 - гидроксид (гидроокись) железа (III)
- Горение железной проволоки в кислороде с образованием смешанного оксида (в нём присутствует элемент и со степенью окисления +2, и со степенью окисления +3):
3Fe+2O2 = Fe3O4 (железная окалина). Реакция возможна при нагревании до 160 ⁰C.
- Взаимодействие с водой при высокой температуре (600−700 ⁰C):
3Fe+4H2O = Fe3O4+4H2
- Реакции с неметаллами:
а) Реакция с галогенами (Важно! При данном взаимодействии приобретает степень окисления элемента +3)
2Fe+3Cl2 = 2FeCl3 - хлорид трёхвалентного железа
 б) Реакция с серой (Важно! При данном взаимодействии элемент имеет степень окисления +2)
б) Реакция с серой (Важно! При данном взаимодействии элемент имеет степень окисления +2)
Сульфид железа (III) - Fe2S3 можно получить в ходе другой реакции:
Fe2O3+ 3H2S=Fe2S3+3H2O
в) Образование пирита
Fe+2S = FeS2 - пирит. Обратите внимание на степень окисления элементов, составляющих данное соединение: Fe (+2), S (-1).
- Взаимодействие с солями металлов, стоящими в электрохимическом ряду активности металлов справа от Fe:
Fe+CuCl2 = FeCl2+Cu - хлорид железа (II)
- Взаимодействие с разбавленными кислотами (например, соляной и серной):
Fe+HBr = FeBr2+H2
Fe+HCl = FeCl2+ H2
Обратите внимание, что в этих реакция получается железо со степенью окисления +2.
- В неразбавленных кислотах, которые являются сильнейшими окислителями, реакция возможна только при нагревании, в холодных кислотах металл пассивируется:
Fe+H2SO4 (концентрированная) = Fe2 (SO4)3+3SO2+6H2O
Fe+6HNO3 = Fe (NO3)3+3NO2+3H2O
- Амфотерные свойства железа проявляются только при взаимодействии с концентрированными щелочами:
Fe+2KOH+2H2O = K2+H2 - тетрагидроксиферрат (II) калия выпадает в осадок.
Процесс производства чугуна в доменной печи
- Обжиг и последующее разложение сульфидных и карбонатных руд (выделение оксидов металла):
FeS2 —> Fe2O3 (O2, 850 ⁰C, -SO2). Эта реакция также является первым этапом промышленного синтеза серной кислоты.
FeCO3 —> Fe2O3 (O2, 550−600 ⁰C, -CO2).
- Сжигание кокса (в избытке):
С (кокс)+O2 (возд.) —> CO2 (600−700 ⁰C)
CO2+С (кокс) —> 2CO (750−1000 ⁰C)
- Восстановление руды, содержащий оксид, угарным газом:
Fe2O3 —> Fe3O4 (CO, -CO2)
Fe3O4 —> FeO (CO, -CO2)
FeO —> Fe (CO, -CO2)
- Науглероживание железа (до 6,7%) и расплавление чугуна (t⁰плавления - 1145 ⁰C)
Fe (твёрдый)+С (кокс) —> чугун. Температура реакции - 900−1200 ⁰C.
В чугуне всегда присутствует в виде зёрен цементит (Fe2C) и графит.
Характеристика соединений, содержащих Fe
Изучим особенности каждого соединения отдельно.
Fe3O4
 Смешанный или двойной оксид железа, имеющий в своём составе элемент со степенью окисления как +2, так и +3. Также Fe3O4 называют железной окалиной
. Это соединение стойко переносит высокие температуры. Не вступает реакцию с водой, парами воды. Подвергается разложению минеральными кислотами. Может быть подвергнуто восстановлению водородом либо железом при высокой температуре. Как вы могли понять из вышеизложенной информации, является промежуточным продуктом в цепочке реакция промышленного производства чугуна.
Смешанный или двойной оксид железа, имеющий в своём составе элемент со степенью окисления как +2, так и +3. Также Fe3O4 называют железной окалиной
. Это соединение стойко переносит высокие температуры. Не вступает реакцию с водой, парами воды. Подвергается разложению минеральными кислотами. Может быть подвергнуто восстановлению водородом либо железом при высокой температуре. Как вы могли понять из вышеизложенной информации, является промежуточным продуктом в цепочке реакция промышленного производства чугуна.
Непосредственно же железную окалину применяют в производстве красок на минеральной основе, цветного цемента и изделий из керамики. Fe3O4 - это то, что получается при чернении и воронении стали. Получают смешанный оксид путём сгорания железа на воздухе (реакция приведена выше). Руда, содержащая оксиды, является магнетитом.
Fe2O3
Оксид железа (III), тривиальное название - красный железняк , соединение красно-коричневого цвета. Устойчиво к воздействию высоких температур. В чистом виде не образуется при окислении железа кислородом воздуха. Не вступает в реакцию с водой, образует гидраты, выпадающие в осадок. Плохо реагирует с разбавленными щелочами и кислотами. Может сплавляться с оксидами других металлов, образуя шпинели - двойные оксиды.
Красный железняк применяется в качестве сырья при промышленном получении чугуна доменным способом. Также ускоряет реакцию, то есть является катализатором, в аммиачной промышленности. Применяется в тех же областях, что и железная окалина. Плюс к этому использовался как носитель звука и картинки на магнитных лентах.
FeOH2
Гидроксид железа (II) , соединение, обладающее как кислотными, так и основными свойствами, преобладают последние, то есть, является амфотерным. Вещество белого цвета, которое быстро окисляется на воздухе, «буреет», до гидроокиси железа (III). Подвержено распаду при воздействии температуры. Вступает в реакцию и со слабыми растворами кислот, и со щелочами. В воде не растворим. В реакции выступает в роли восстановителя. Является промежуточным продуктом в реакции коррозии.
Обнаружение ионов Fe2+ и Fe3+ («качественные» реакции)
Распознавание ионов Fe2+ и Fe3+ в водных растворах производят с помощью сложных комплексных соединений - K3, красная кровяная соль, и K4, жёлтая кровяная соль, соответственно. В обеих реакциях выпадает осадок насыщенного синего цвета с одинаковым количественным составом, но различным положением железа с валентностью +2 и +3. Этот осадок также часто называют берлинской лазурью или турнбуллевой синью.
Реакция, записанная в ионном виде
Fe2++K++3- K+1Fe+2
Fe3++K++4- K+1Fe+3
Хороший реактив для выявления Fe3+ — тиоцианат-ион (NCS-)
Fe3++ NCS- 3- — эти соединения имеют ярко-красную («кровавую») окраску.
Этот реактив, например, тиоцианат калия (формула - KNCS), позволяет определить даже ничтожно малую концентрацию железа в растворах. Так, он способен при исследовании водопроводной воды определить, не заржавели ли трубы.