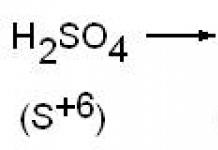УДК 547
ББК 24.23
Рецензенты: кафедра органической химии Ярославского государственного педагогического университета; В.Н.Казин, канд. хим. наук, доцент кафедры общей и биоорганической химии Ярославского государственного университета.
Колпащикова И.С., Кошкин Л.В., Кофанов Е.Р., Обухова Т.А.
К60 Органическая химия. Часть II. Арены. Галогенпроизводные углеводородов: Учебное пособие / Яросл. гос. техн. ун-т.- Ярославль, 1999.- 70 с.
ISBN 5-230-18418-3
Во второй части пособия рассмотрены основные вопросы строения и реакционной способности, типичные реакции и основные способы получения аренов и галогенпроизводных. По указанным разделам приведены контрольные работы.
Предназначено для студентов-заочников химико-технологических специальностей, а также может быть рекомендовано для студентов дневной формы обучения.
Ил. 8. Табл. 4. Библиограф. 6.
ББК 24.23
ISBN 5-230-18418-3 Ó Ярославский государственный
технический университет
АРЕНЫ
Строение бензола. Ароматичность
К аренам относятся соединения, содержащие, по крайней мере, одну бензольную группировку.
В современной химической литературе понятие “соединение ароматического ряда” означает сходство химических свойств соединения со свойствами бензола и не связаны с запахом соединений.
В соответствии с молекулярной формулой С 6 Н 6 бензол является ненасыщенным соединением и можно ожидать, что для него характерна тенденция вступать в типичные для алкенов реакции присоединения. Однако в условиях, в которых алкен быстро вступает в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не вступает в реакции присоединения, в которых разрушилась бы p -электронная система бензольного кольца. Такая устойчивость называется кинетической . Она связана со значительной величиной энергии активации. Вместе с тем бензол достаточно легко вступает в реакции замещения. Образующиеся при этом продукты сохраняют специфическую структуру бензола.
Таблица 1.1. Сравнение химических свойств циклогексена и бензола
Вывод об устойчивости ароматической системы следует из сравнения теплот гидрирования одного моля 1,3,5-циклогексатриена, содержащего три независимые двойные и три простые связи. Можно ожидать, что теплота гидрирования 1,3,5-циклогексатриена будет равна утроенной теплоте гидрирования одного моля циклогексена: 120,4 ´ 3 =361,2 кДж.


Однако экспериментальная теплота гидрирования одного моля бензола составляет 209 кДж, что на 152 кДж меньше. Следовательно, бензол беднее энергией, чем гипотетический 1,3,5-циклогексатриен. Эта энергия называется энергией резонанса . Стабилизация за счет энергии резонанса является причиной термодинамической устойчивости .
В бензоле каждый атом углерода находится в sp 2 -состоянии и связан тремя s -связями с двумя атомами углерода и одним атомом водорода. Атомы углерода и водорода лежат в одной плоскости. Четвертый валентный электрон атома углерода находится на 2p -орбитали, перпендикулярной плоскости молекулы. Эти p -орбитали состоят из двух одинаковых долей, одна из которых лежит выше, другая - ниже плоскости кольца. 2р -орбиталь каждого атома углерода перекрывается с 2р -орбиталями обоих соседних атомов углерода. В результате образуется замкнутая шести-p -электронная система в виде двух бубликов, один из которых лежит выше, а другой ниже плоскости правильного шестиугольника (рис. 1.1а).
Благодаря коллективному взаимодействию всех шести p-электронов происходит выравнивание углерод-углеродных связей по длине и кратности: длина всех связей С-С в бензоле (0,1399 нм) является средней между длиной двойной связи в алкенах (0,134 нм) и расчетным значением длины простой связи =С-C=(0,148 нм) (рис. 1.1б). Вторым следствием коллективного p- электронного взаимодействия является электронная и связанная с ней термодинамическая и кинетическая стабилизация.

Рис. 1.1.Молекула бензола:
а - перекрывание 2р-орбиталей, образующих p- связи;
б - длины связей и валентные углы в молекуле бензола
Какие свойства должно проявлять вещество для того, чтобы его можно было отнести к ароматическим соединениям? Ароматическими являются соединения с молекулярной формулой, указывающей на высокую степень ненасыщенности, которые, однако, не реагируют как ненасыщенные, а вступают в реакции электрофильного замещения с сохранением термодинамически устойчивой ароматической системы.
Условие ароматичности определяет правило Хюккеля .
Ароматические углеводороды (арены)
Представители ароматических углеводородов - бензол С 6 Н 6 и его гомологи -имеют циклическое строение. Οʜᴎ могут иметь насыщенные или ненасыщенные боковые цепи. Некоторые из производных бензола обладают приятным запахом. По этой причине сохранилось их прежнее историческое название - ароматические углеводороды. Сегодня известны многие вещества, которые по строению и химическим свойствам следует отнести к ароматическим углеводородам. Бензол является самым типичным представителем ароматических углеводородов, в молекуле которого шесть атомов углерода.
Экспериментальные данные показывают, что в молекуле бензола 92,3 % углерода, как и в молекуле ацетилена. Следовательно, простейшая формула бензола должна быть такая же, как у ацетилена, - СН. Но плотность паров бензола по водороду равна 39, а масса его моля - 78 г (2D H = 2‣‣‣39). В случае если формула бензола действительно была бы СН, то масса его моля должна быть 13 г, а не 78 ᴦ. Следовательно, молекула бензола состоит из шести атомов углерода и шести атомов водорода (78: 13 = 6), а его молекулярная формула С 6 Н б.
Эксперименты показали, что при повышенной температуре и в присутствии катализаторов к каждой молекуле бензола присоединяются три молекулы водорода и образуется циклогексан. Этим доказывается, что бензол имеет циклическое строение. При этом эксперименты показали, что все связи в молекуле бензола равноценны.
Согласно современным представлениям, в молекуле бензола у каждого атома углерода одно s- и два р-электронных облака гибридизованы (sp 2 -гибридизация), а одно р-электронное облако негибридизованное. Все три гибридизованных электронных облака, перекрываясь с гибридизованными облаками соседних атомов углерода и s-облаками атомов водорода, образуют три σ-связи, которые находятся в одной плоскости. Негибридизованные р-электронные облака атомов углерода расположены перпендикулярно плоскости направления σ -связей. Эти облака тоже перекрываются друг с другом (рис. 40).
В цикле молекулы бензола нет трех отдельных двойных связей: негибридизованное р-электронное облако первого атома углерода перекрывается с негибридизованными р-электронными облаками второго и шестого атомов углерода, а р-электронное облако второго атома углерода перекрывается с негибридизованными р-электронными облаками первого и третьего атомов углерода
Так как электронная плотность в молекуле бензола распределена равномерно, то правильнее структурную формулу бензола изображать в виде шестиугольника с окружностью внутри. Известно много сходных с бензолом ароматических углеводородов - гомологов бензола. Соединения углерода и водорода, в молекулах которых имеется бензольное кольцо, или ядро, относятся кароматическим углеводородам. Сегодня используют формулу I (Фридриха Кекуле (1829-1896) 1865 ᴦ.) или III. Радикал –С 6 Н 5 принято называть фенилом.
Строение молекулы бензола - понятие и виды. Классификация и особенности категории "Строение молекулы бензола" 2017, 2018.
Современная точка зрения на строение бензола: плоская молекула, атомы углерода которой находятся в состоянии sp 2 -гибридизации и объединены в правильный шестиугольник.

Изображение молекулы бензола:
![]()
Ароматичность - необычайно низкая энергия невозбужденного состояния, вызванная делокализацией π-электронов.
Ароматичность -понятие, характеризующее совокупность структурных, энергетических свойств и особенностей реакционной способности циклических структур с системой сопряженных связей
Признаки ароматичности Любое соединение обладает ароматичностью, если оно имеет: а) плоский замкнутый цикл; б) сопряженную π−электронную систему, охватывающую все атомы цикла; в) если число электронов, участвующих в сопряжении соответствует формуле Хюккеля (4n+2., где n - число циклов).
Изомерия

Номенклатура

орто- , мета- и пара- замещенными:


Физические свойства
Все ароматические соединения имеют запах. Бензол, толуол, ксилолы, этилбензол,
кумол, стирол - жидкости, нафталин, антрацен - твердые вещества.
26. Ароматические углеводороды ряда бензола. Номенклатура. Изомерия. Способы получения бензола и его гомологов: из каменноугольной смолы, ароматизацией и дегидроциклизацией парафинов, по реакции Вюрца-Фиттига, алкилированием по Фриделю-Крафтсу олефинами, галоидными алкилами, спиртами, из солей бензойной кислоты, тримеризацией алкинов.
Арены(ароматические углеводороды) - это циклические соединения, в молекулах которых содержатся одно или несколько ядер бензола. Эмпирическая формула бензола С6Н6
Изомерия
Для ди-, три- и тетразамещенных ароматических углеводородов характерна изомерия положения заместителя и изомерия боковой алкильной цепи.

Моно-, пента- и гексазамещенные арены не имеют изомеров, связанных с положением заместителя в кольце.
Номенклатура
Производные бензола называют замещенными бензолами. Для многих из них либо используют тривиальные названия, либо заместитель обозначается приставкой перед словом «бензол». В случае монозамещенных бензолов в названия не входят цифры, так как все шесть атомов углерода молекулы бензола равноценны, для каждого заместителя возможен только один монозамещенный бензол.

Если в молекуле бензола присутствуют два заместителя, то могут существовать три различных дизамещенных бензола. Они называются соответственно орто- , мета- и пара- замещенными:

Если в бензоле имеется три и более заместителей, то их положение в кольце следует обозначать только цифрами. Во всех случаях названия заместителей перечисляют перед словом «бензол» в алфавитном порядке. Цифра 1 в названии может быть пропущена, заместитель, с которого начинается отсчет, в этом случае входит в основу названия:

Получение:
1.Переработка каменноугольной смолы, перегонка нефти, cухая перегонка
древесины.
2. Ароматизация нефти.

3. Дегидроциклизация гексана и гептана.
C 6 H 14 → С6H6 + 4H 2
C 7 H 16 → С6H5-СН3 + 4H2
4. Вюрца-Фиттига:

Алкилирование по Фриделю – Крафтсу. Принято два возможных механизма протекания реакции. В первом случае электрофильной частицей является карбокатион, образующийся в результате взаимодействия галогеналкана с хлоридом алюминия (кислотой Льюиса):
Во втором случае можно предполагать, что электрофилом служит алкильная группа полярного комплекса AlCl 3 с алкилгалогенидом.
Алкилирование бензола (реакция Фриделя-Крафтса)
C 6 H 6 + C 2 H 5 Cl → С 6 H 5 -C 2 H 5 + HCl
27.Электрофильное замещение в ароматическом ряду (нитрование, сульфирование, галогенирование, алкилирование и ацилирование по Фриделю-Крафтсу). Понятие о - и -комплексах. Механизм реакций электрофильного замещения
Электронное и пространственное
строение бензола
10 класс (профильный уровень)
Цель. Cформировать понятие об ароматической связи, особенностях электронного строения и обусловленных ими химических свойствах бензола.
Задачи. Всесторонне рассмотреть строение бензола как наиболее важного представителя ароматических углеводородов; выяснить природу ароматичности.
Тип урока. Проблемная лекция.
Для того чтобы повысить мотивацию обучающихся для более успешного усвоения новой темы, можно заранее подготовить карточки с фамилиями учеников, перемешать их и объявить, что в конце урока нескольким школьникам из присутствующих достанутся вопросы, а вот кому, ребята узнают позже.
ХОД ЗАНЯТИЯ
Учитель. Как вы думаете, откуда произошло название «ароматические углеводороды»?
Первые представители класса ароматических углеводородов (аренов), выделенные из природных объектов, обладали своеобразным приятным запахом и получили название «ароматических». Однако сегодня в понятие «ароматический углеводород» вкладывают совсем другой смысл.
Урок целесообразно начать с рассмотрения химических свойств, сравнения и анализа полученных результатов и их обобщения.
Демонстрационные опыты
1) Горение бумаги, смоченной бензолом: указывает на возможную непредельность молекулы бензола, поскольку пламя коптящее, подобно пламени ацетилена.
2) Приливание бромной воды и раствора перманганата калия к бензолу: не подтверждает непредельный характер молекулы бензола.
Исходя из этого, обучающиеся приходят к выводу о специфичности химических свойств бензола, а следовательно, и строении молекулы.
Вопросы ученикам
1) Охарактеризуйте химические свойства бензола.
2) От чего зависят свойства вещества?
3) На что указывает коптящее пламя?
4) На что указывает отсутствие реакции с перманганатом калия и бромной водой?
Учитель записывает брутто-формулу бензола (С 6 Н 6) и предлагает составить возможные варианты структурных формул линейного и циклического строения.
Историческая справка
Может быть заранее подготовлена одним из обучающихся, а может быть сделана несколькими учениками в форме презентации.
В 1825 г. М.Фарадей выделил из светильного газа углеводород и исследовал его состав и свойства. Э.Митчерлих в 1835 г. нагреванием бензойной кислоты с негашеной известью получил углеводород, который оказался тождественным веществу, полученному Фарадеем. Митчерлих установил его формулу – С 6 Н 6 , Либих позднее назвал бензолом.
Особое внимание к этому углеводороду на протяжении уже более полутора столетий объясняется его специфическими свойствами.
Первая попытка объяснения таких свойств бензола была предпринята в 1865 г. А.Кекуле (рис. 1).
Наряду с формулой Кекуле были предложены и другие формулы бензола (рис. 2).
Учитель рассказывает о взаимодействии бензола с тремя молекулами водорода с образованием циклогексана и о получении бензола пропусканием ацетилена через нагретые до 500 °С стружки железа, отмечает, что структурная формула бензола должна соответствовать шестиугольнику с чередующимися двойными и одинарными связями.
Уравнения записываются на доске:
С 6 Н 6 + 3Н 2 -> С 6 Н 12 ,
3С 2 Н 2 -> С 6 Н 6 .
Далее учитель сообщает некоторые данные о циклическом строении бензола, акцентирует внимание на следующих моментах: на расположение всех атомов в одной плоскости и одинаковое расстояние между ядрами соседних атомов углерода. Благодаря открытию метода рентгеноструктурного анализа стало возможным объяснить строение молекулы бензола: при sp 2 -гибридизации из одной s -орбитали и двух p -орбиталей образуются три гибридные орбитали и остается одна негибридная р -орбиталь.
Гибридные орбитали образуют три -связи, а негибридные располагаются перпендикулярно плоскости и образуют единое -электронное облако.
Понятие об электронном строении бензола подкрепляется таблицами, моделями с диска «Электронный учебник. Открытая химия 2,5»; объемными моделями с диска «Учебное электронное издание. Виртуальная лаборатория. Химия. 8–11 классы».
Учитель. Давайте подумаем, если в молекуле присутствует -связь, то почему же не происходят характерные для алкенов реакции (присоединение брома и окисление перманганатом калия)?
О т в е т. Сочетание шести -связей с единой -электронной системой называется ароматической связью. Электронная плотность распределена равномерно. Следовательно, в молекуле бензола нет ни простых, ни двойных связей. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные для бензола свойства. Цикл из шести атомов углерода, связанных шестью -cвязями и единым -электронным облаком, называют бензольным кольцом или бензольным ядром.
Физические методы исследования показали следующее (см. таблицу).
Таблица
Строение молекулы бензола
Напоминаю, что валентный угол 120 ° соответствует sp 2 -гибридизации атомов углерода.
Итак, давайте подведем итог изучения строения молекулы бензола.
Здесь можно воспользоваться заготовленными карточками с фамилиями, а можно попробовать задать вопрос по адресу. Заранее на подготовленных карточках пишется адрес, например: «улица 1, дом 3, квартира 1», где улица – номер ряда, дом – номер парты, квартира – вариант. Вытаскивается карточка, определяется ученик, «живущий» по этому адресу, и ему задается вопрос, затем вытаскивается следующая карточка.
Примеры вопросов
1) Какова формула молекулы бензола?
2) Какой тип гибридизации у атомов углерода в этой молекуле?
3) Что такое ароматичность?
4) Как влияет строение молекулы на свойства вещества?
5) В каком году и кем был впервые получен бензол?
Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи — ядро бензола. Международное название ароматических углеводородов — арены.
Простейшим представителем аренов является бензол С 6 Н 6 . Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865):
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Электронное строение бензола.
Каждый атом углерода в молекуле бензола находится в состоянии />sp 2 -гибридизации. Он связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. В результате образуется плоский шестиугольник: все шесть атомов углерода и все σ-связи С-С и С-Н лежат в одной плоскости. Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели и ориентировано перпендикулярно к плоскости бензольного кольца. Такие р-электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца  . В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей
. В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей  ./>/>
./>/>
p -Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола — устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I ). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II